Links
- Lexikon der Elemente → Schwefel
- Mineralienatlas – Schwefel
Umfangreiche Monographie zum Schwefel, mit tollen Bildern.
Verhalten von Schwefel beim Erhitzen
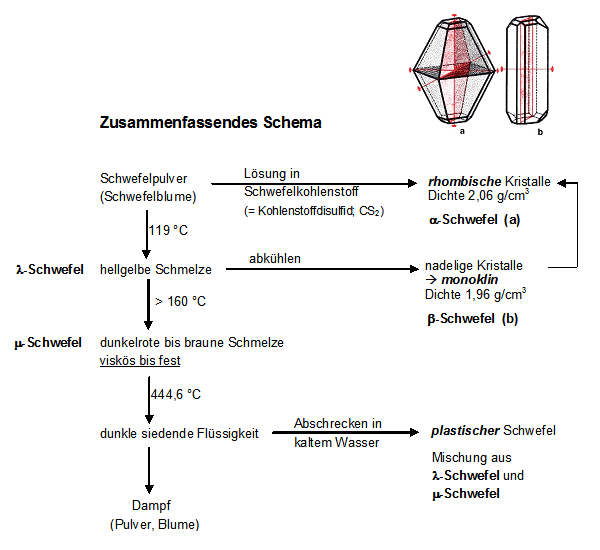
- Bis 95,6 °C liegt gelber α-S8-Schwefel in kristalliner Form als orthorhombischer Schwefel vor.
- Oberhalb von 95,6 °C wandelt sich der orthorhombische in den monoklinen
β-S8-Schwefel um - β-Schwefel schmilzt bei 119,6 °C und liegt ab dieser Temperatur als sogenannter
λ-S8-Schwefel vor. Es handelt sich um eine leichtflüssige Schmelze, die aus S8-Ringen besteht. - Beim weiteren Erhitzen erfolgt Umwandlung in den sogenannten π-Schwefel mit niedermolekularen Ringen der Ringgrößen n von 6 bis ca. 26.
- μ-Schwefel besteht aus Sx-Ketten mit x=103 bis 106 und ist dunkelbraun und zähflüssig. Diese Modifikation kann durch Abschrecken in Form des plastischen Schwefels erhalten werden, der die für ein Polymer charakteristischen Eigenschaften zeigt.
- Bei 444,6 °C siedet Schwefel unter Bildung molekularer Spezies Sx mit x zwischen eins und acht. In dem zunächst dunkelbraunen Gas liegen die verschiedenen Moleküle in einem temperaturabhängigen Gleichgewicht nebeneinander vor. Ab 1800 °C liegen nur noch einzelne Schwefel-Atome vor.
In Tabellenform zum Ausdrucken
Das Wichtigste im Überblick
Allotropie
(griech.: allo- = ein anderer) bezeichnet die Erscheinung, dass ein chemisches Element in zwei oder auch mehr Modifikationen (Strukturformen) im gleichen Aggregatzustand auftritt, die sich physikalisch und auch in ihrer chemischen Reaktionsbereitschaft voneinander unterscheiden.
Sie findet sich zum Beispiel bei Kohlenstoff, welcher sowohl als farbloser, extrem harter Diamant vorkommt, der ein elektrischer Nichtleiter ist, wie auch als schwarzer, weicher Graphit, der elektrischen Strom leitet und auch als Makromolekül Fulleren, des Weiteren bei Phosphor, der als giftiger, selbstentzündlicher weißer Phosphor existiert, im Gegensatz zum roten oder schwarzen Phosphor, der erst nach Aktivierung brennt. Weitere Beispiele sind Schwefel, Selen, Eisen (α-, γ-Eisen) oder Zinn (α-Sn und β-Sn; bei der Umwandlung von β-Sn zu α-Sn kann dann die Zinnpest auftreten).
Eine allotrope Modifikation von Sauerstoff (O2) ist Ozon (O3).
Hingegen spricht man bei den unterschiedlichen Isotopen eines Elementes nicht von Allotropie. Tritt eine chemische Verbindung im festen Zustand in mehreren Kristallformen auf, spricht man von Polymorphie.
Quelle: Wikipedia: Allotropie • CC BY-SA 3.0 • Autorenliste
Reaktion von Schwefel mit Eisen
Quelle: YouTube-Video von ChemToddler • hochgeladen am 17.08.2008